Al Via in Tutto il Mondo i Trattamenti Radiochirurgici ZAP per i Tumori a voi Tutti i Dettagli Tecnici Inerenti Questa Nuova Tecnologia Ispirata a Nikola Tesla
Ne avevamo già parlato in due articoli precedenti e abbiamo voluto mettere a disposizione del pubblico che ci segue una dettagliata analisi dell’’Holographic Medical Beds che un po alla volta si stanno un po alla volta istallando in giro per il mondo.
Si sente sempre parlare della terapia del secolo per il cancro che la ricerca medica non potrà mai risolvere e tutti sono alla continua ricerca dello spot del giorno per accaparrarsi visibilità e finanziamenti (Servono solo per togliervi soldi dalle tasche) e questo purtroppo lo sanno solo coloro che fanno a capo ai grossi gruppi finanziari e multinazionali annesse.
Vi avvisiamo già da subito che quello che avrete modo di vedere è un servizio prettamente tecnico per gli addetti ai lavori, in quanto non volevamo lasciare nulla al caso, ma se volete conoscere quelli che sono le potenzialità di questa tecnologia messa in atto vi rimando a questi due articoli Qui e Qui dove potete farvi un idea di ciò che stiamo parlando.
Noi siamo convinti che quello che viene immesso nel mercato in questo momento ( Qui la industria che lo produce ) sia solo un anticipo sviluppato a scopi commerciali che sfrutta solo in parte le sue reali potenzialità, li dove non dobbiamo dimenticarlo quello che avete modo di vedere è stato sino ad ora un settore di ricerca dell’industria militare.
Nikola Tesla avrebbe fatto di meglio e con molto meno, ma si sa, il denaro ha delle priorità che lui non conosceva, fermo restando che sino ad ora ogni struttura ( E sono pochissime) possono far fronte ad un numero molto ridotto di persone per le terapie i cui costi sono estremamente elevati… mai quanto quelli di un mese di guerra in Ucraina.
Sarà nostra cura in seguito di inserire gli ospedali che hanno da poco installato queste postazioni che sono monopolio al momento di importanti strutture ospedaliere.
Toba60
Noi di Toba60 mediamente abbiamo dalle 12.000 fino a 45.000 persone nei periodi di punta che leggono i nostri editoriali quotidianamente da ogni parte del mondo, ed il numero aumenta in modo esponenziale ogni mese.

È un lavoro enorme e le credenziali acquisite ci pongono spesso al centro di continue intimidazioni che onestamente per noi sono la certezza di aver intrapreso la strada giusta.
Non abbandonateci….
e supportateci attraverso un importo sulla base dalle vostre possibilità, il nostro lavoro è importante. abbiamo in sospeso centinaia per non dire migliaia di servizi fondamentali e utili per far conoscere le molte realtà ai più sconosciute o poco note, li dove non abbiamo orari per far fronte alle mille problematiche che comporta un Magazine come quello di Toba60
Toba60
Perché fare un abbonamento con Toba60
Il nostro lavoro come ai tempi dell’inquisizione è diventato attualmente assai difficile e pericoloso, ci sosteniamo in prevalenza grazie alle vostre donazioni volontarie mensili e possiamo proseguire solo grazie a queste, contribuire è facile, basta inserire le vostre coordinate già preimpostate all’interno dei moduli all’interno degli editoriali e digitare un importo sulla base della vostra disponibilità.
I Dossier e le ricerche che voi avete modo di consultare qui dentro implicano per noi settimane di lavoro ed anche l’importo mensile di un Caffè è per noi fondamentale per poter dare continuità ad un progetto la cui utilità ci è riconosciuta in oltre 140 paesi da tutto il mondo.
Fatelo tutti e non voltate lo sguardo dall’altra parte, quello lasciatelo fare a chi in questo momento si sta adoperando in tutti i modi per impedirci di dare seguito ad un qualcosa che un sistema perverso considera sconveniente!
Staff Toba60

Al Via in Tutto il Mondo i Trattamenti Radiochirurgici ZAP
Lo scopo di questo articolo è indagare e caratterizzare da un punto di vista fisico lo Zap-X (ZAP Surgical Systems, Inc., San Carlos, CA), un nuovo sistema dedicato di radiochirurgia autonomo e autoschermato, concentrandosi sull’energia e sulle prestazioni del fascio, sulle perdite, sulla sicurezza delle radiazioni, sull’accuratezza dell’erogazione della dose, sulle normative, sulla garanzia di qualità e sulla pianificazione del trattamento. Questa indagine è necessaria per stabilire le specifiche meccaniche e le prestazioni complessive del sistema e per stabilire i parametri di riferimento per il futuro utilizzo clinico.
I metodi applicati comprendono misurazioni dell’energia, delle dimensioni del punto focale, delle prestazioni del fascio, della dosimetria, dei dati del fascio, del sistema di pianificazione del trattamento, delle radiazioni di dispersione, dei test di accettazione e della messa in funzione.
I risultati della caratterizzazione rivelano un acceleratore lineare (linac) da 3 megavolt (MV) con una dimensione del punto focale di 2 mm, un rateo di dose di 1.500 MU/min all’isocentro con una linearità di dose del 3%, una penombra del fascio inferiore a 3 mm e una simmetria del fascio inferiore al 2%. Le prestazioni del fascio e le caratteristiche dosimetriche sono adatte alla radiochirurgia intracranica.
Si può concludere che il sistema è risultato conforme ai requisiti di sicurezza, accuratezza e prestazioni ampiamente accettati nel settore della radioterapia e dell’oncologia. Inoltre, il sistema ha dimostrato di soddisfare le esigenze pratiche e cliniche della comunità dei radiochirurghi.
Introduzione
Lo Zap-X è un nuovo sistema di radiochirurgia dedicato, autonomo e autoschermato, sviluppato e prodotto dalla ZAP Surgical Systems, Inc. di San Carlos, California. Questo dispositivo è destinato al trattamento di radiochirurgia stereotassica (SRS) di lesioni intracraniche e cervicali benigne e maligne. Un acceleratore lineare in banda S (linac) da 3 megavolt (MV) è la fonte di radiazioni terapeutiche. Simile a un grande giroscopio, il linac è montato all’interno di una combinazione di cardani accoppiati con schermatura antiradiazioni, ciascuno dei quali ruota accuratamente intorno a un isocentro comune. Questa struttura meccanica permette al fascio di linac di incrociare potenzialmente il fuoco da circa 2π steradiani di angolo solido, come è idealmente richiesto per la SRS cranica.
L’accurato posizionamento del fascio terapeutico è ottenuto grazie alle rotazioni indipendenti a due assi dell’acceleratore e ai movimenti precisi di un tavolo paziente robotizzato. La maggior parte dei componenti necessari per la produzione del fascio, come la sorgente di energia a radiofrequenza, il sistema di guida d’onda e l’elettronica di attivazione del fascio, nonché un’importante schermatura delle radiazioni, sono montati o integrati nella camera di trattamento sferica rotante del paziente. Il paziente è sostenuto da un tavolo di trattamento mobile che si estende all’esterno della sfera di ferro, ma che è anch’esso racchiuso da un’ulteriore schermatura dalle radiazioni durante la radiochirurgia. Questa schermatura del tavolo è costituita da un guscio di ferro rotante e da una porta pneumatica su un telaio in acciaio.
Relazione tecnica
Lo Zap-X è illustrato nella Figura 1 ed è stato descritto più dettagliatamente in precedenti pubblicazioni [1-3]. Le figure 2-3 mostrano viste marcate del sistema Zap-X in funzione e la copertura del fascio.



Per caratterizzare il sistema Zap-X, sono stati studiati e/o implementati i seguenti argomenti:
1) schermatura del sistema
2) L’energia dell’acceleratore lineare, che consente di ricavare sia l’energia nominale che il potenziale di accelerazione.
3) La dimensione del punto focale, misurata con una “telecamera” di dimensioni personalizzate, che ha permesso di far passare esclusivamente la radiazione primaria attraverso un gruppo di foglie di tungsteno strettamente impilate.
4) La radiazione di dispersione del collimatore del linac
5) Un’indagine completa sulle radiazioni all’esterno della sfera schermata e dell’alloggiamento dello Zap-X, con la derivazione della dose annuale prevista.
6) la riproducibilità e la linearità della camera di ionizzazione del monitor di dose
7) La conformità del sistema Zap-X alle normative della Commissione Elettrotecnica Internazionale (IEC) [4].
8) Specifiche delle prestazioni del fascio e test di accettazione
9) Una serie completa di dati sul fascio, come richiesto dal sistema di pianificazione del trattamento.
10) Un programma completo di garanzia della qualità (QA).
Ogni singolo compito è stato affrontato per stabilire la rappresentazione più descrittiva possibile dell’acceleratore lineare, che in ultima analisi aiuterà l’utente pratico a comprendere meglio le capacità, i limiti e le caratteristiche del sistema Zap-X.
Progettazione della schermatura del sistema
Il sistema Zap-X è costituito da due schermi che si muovono indipendentemente l’uno dall’altro su assi separati da un angolo di 45 gradi. Il metodo di progettazione viene applicato per determinare lo spessore dello schermo Zap-X a cui è collegato il linac/collimatore. Una volta calcolato il profilo di spessore, il profilo di spessore maggiore viene applicato a ciascuna sezione trasversale dello scudo.
La Figura 1 illustra i componenti che costituiscono la schermatura dalle radiazioni del sistema Zap-X, tra cui il gruppo collimatore, il fermo del fascio allineato con l’asse del fascio di trattamento/collimatore, uno schermo mobile che costituisce la schermatura secondaria per proteggere i dipendenti della struttura e il pubblico in generale, il paziente all’interno del sistema di autoschermatura e il confine che limita l’area controllata.
Oltre a puntare il fascio di radioterapia sulla testa o sul collo del paziente, il sistema deve fornire una schermatura adeguata per limitare l’esposizione alle radiazioni del pubblico e dei dipendenti della struttura a un livello accettabile. L’autoschermatura di Zap-X è progettata per raggiungere un limite dell’area di controllo in un raggio non superiore a 3 metri dall’isocentro. Il sistema deve inoltre limitare la dispersione di radiazioni al paziente a meno dello 0,1%. Il gruppo del revolver multicollimatore serve anche a schermare questa perdita di radiazioni. Per raggiungere tali limiti di esposizione alle radiazioni, gli schermi mobili e statici devono essere progettati sulla base dei risultati di un modello di simulazione Monte Carlo. L’input di questo modello sarà l’energia del linac (MV) e l’intensità di dose massima (cGy/min). La dose massima per il pubblico in generale (cioè per chi appartiene all’area non controllata) richiesta dal National Council on Radiation Protection and Measurement (NCRP) è di 1 millisievert (mSv)/anno, che equivale a 100 milliroentgens (mR)/anno. Per un totale di 2.000 ore di lavoro all’anno, ciò comporta un’esposizione di 0,05 mR in ogni ora.
Le simulazioni Monte Carlo hanno previsto la distribuzione angolare per il primo, il secondo e il terzo strato del valore in decimi per la radiazione diffusa dal bersaglio del linac (schermato dal gruppo collimatore) e la distribuzione angolare per il primo, il secondo e il terzo strato del valore in decimi per la radiazione diffusa dalla testa del paziente. Per i requisiti di progettazione della schermatura dei dispositivi medici, si devono ipotizzare le condizioni peggiori e definire l’intensità di dose massima (D), il numero di pazienti (Np) alla settimana, il tempo medio di trattamento (T min/paziente), il tempo di qualificazione e calibrazione che non deve superare una certa durata (Tqc) alla settimana, il carico di lavoro totale (W = Np x T + Tqc ore alla settimana), l’utilizzo (U), aggiungere un fattore di sicurezza (SF) e il numero di settimane (Nw) di funzionamento in un anno.
La radiazione equivalente in tempo per anno è calcolata applicando la seguente formula: U x W x SF x Nw (h/anno). Da questo risultato è possibile determinare il limite di esposizione alle radiazioni ammissibile al confine dell’area controllata. Questo è il requisito principale utilizzato per progettare lo spessore della schermatura del dispositivo e determinare il raggio dell’area di controllo sferica.
Con la prima distribuzione angolare (1), lo spessore del gruppo collimatore deve essere progettato/calcolato per fornire un’attenuazione della radiazione diffusa dal bersaglio dell’ordine dello 0,001%. Per aumentare la copertura del fascio di trattamento intorno alla testa del paziente, il gruppo collimatore è stato realizzato in tungsteno per ridurre al minimo lo spessore richiesto. Lo spessore dello schermo mobile e statico attorno al paziente è stato determinato in base alla radiazione dispersa dal collimatore e alla radiazione diffusa dal paziente.
I materiali di schermatura utilizzati sono stati quelli ad alta densità, come il tungsteno, il piombo e il ferro. Il ferro è il materiale principale utilizzato per gli schermi di diffusione secondaria. Il piombo e il tungsteno sono stati utilizzati ogni volta che lo spessore del ferro duttile progettato superava i limiti del lavoro spaziale del sottosistema meccanico. Per valutare il profilo dello spessore di schermatura richiesto, si utilizza un sistema di coordinate polari centrato sull’isocentro e si discretizza il confine del limite di radiazione pubblico (1 mSv) in funzione dell’angolo. Per ogni punto di tale confine, è possibile risolvere sia lo spessore per attenuare la dispersione di radiazione del collimatore, sia lo spessore per attenuare la radiazione diffusa dal paziente. Poiché il sistema è simmetrico attorno all’asse del fascio, lo spessore può essere valutato per un intervallo di angoli compreso tra 0 gradi, allineato con la direzione del fascio di radiazioni, e 180 gradi. Quindi, il profilo di spessore del primo schermo (cioè quello che sostiene il linac/collimatore) viene fatto ruotare intorno all’asse del fascio di trattamento delle radiazioni per ottenere il volume/camera di schermatura tridimensionale (3D).
Una volta calcolato il profilo di spessore, il profilo di spessore più grande per lo scenario di radiazione peggiore viene applicato a ogni sezione trasversale del secondo schermo che si muove rispetto al primo. Gli schermi del sistema Zap-X sono stati progettati utilizzando i profili di schermatura calcolati ed è stato costruito un primo sistema pilota di produzione.
Caratterizzazione dell’energia dell’acceleratore lineare
L’acceleratore lineare è un componente chiave del Sistema Zap-X, poiché produce la radiazione fotonica terapeutica utilizzata per il trattamento dei pazienti. La sua qualità penetrativa è stata attentamente calibrata per essere la più adatta al trattamento di bersagli intracranici. Per ottenere la più bassa dose al cervello intero (e mantenere una penetrazione del fascio sufficiente per gli acceleratori lineari terapeutici), è auspicabile ottenere una dose percentuale di profondità (PDD) sull’asse centrale (cax) del 60%-70% alla profondità di trattamento più comunemente utilizzata. Poiché la profondità comune per la radiochirurgia intracranica è di circa 5 cm, il fascio di fotoni da 3,0 MV con una PDD del 66% a questa profondità sembra ben adattato al trattamento di bersagli SRS intracranici. Questa radiazione fotonica è prodotta dall’interazione di bremsstrahlung degli elettroni accelerati con i nuclei del materiale di tungsteno del bersaglio. Il fascio Linac è stato misurato utilizzando una scansione della dose in profondità in un fantasma d’acqua PTW 3D (Physikalisch-Technische Werkstaetten, Freiburg, Germania) a 100 cm di distanza sorgente-superficie (SSD) e dati di riferimento tratti dal British Journal of Radiology, Supplement 17 . Lo spettro energetico degli elettroni e la PDD di bremsstrahlung dei fotoni risultante sono mostrati rispettivamente nelle figure 4-5.


R: lettura; Ds: dose superficiale; D100: dose a 100 mm di profondità; QI: indice di qualità; NAP (MV): potenziale di accelerazione nominale (megavoltaggio); SSD: distanza della superficie della sorgente
Misura della dimensione della macchia focale e della penombra del raggio
Per determinare le dimensioni del fuoco del fascio di fotoni è stata progettata una telecamera per la misurazione delle dimensioni del punto focale. La dimensione dello spot focale ha un impatto diretto sulla penombra geometrica del fascio e una penombra piccola consente di creare gradienti di dose ripidi in corrispondenza dell’interfaccia tra bersaglio e struttura anatomica critica. Una dimensione del punto focale significativamente inferiore a 2 mm potrebbe causare danni strutturali al bersaglio a causa dell’incapacità di dissipare sufficientemente il calore nel materiale del bersaglio e delle temperature che superano il punto di fusione.
La telecamera era costituita da 100 foglie di fogli di tungsteno (W) di 0,1 mm di spessore, alternate a distanziatori di carta di 0,1 mm, entrambi di dimensioni pari a circa 5 cm x 8 cm. Le foglie e i distanziatori sono stati tenuti saldamente in posizione da piastre di alluminio a staffa. La telecamera a punto focale è stata posizionata direttamente a valle della ruota del collimatore del linac a SSD = 22,8 cm sul bordo a monte della telecamera. È stato scelto un collimatore da 7,5 mm e la telecamera a punti focali è stata posizionata con il bordo lungo della telecamera rivolto verso l’alto e l’asse del fascio centrale lungo il piano delle foglie. Le esposizioni sono state effettuate con pellicola Gafchromic™ (Ashland Advanced Materials, Bridgewater NJ) per registrare il modello di trasmissione radiografica, sia nel piano della ruota del collimatore sia nell’orientamento perpendicolare alla ruota del collimatore. Le esposizioni sono mostrate nella Figura 6. La dimensione della macchia focale della telecamera è mostrata nella Figura 7.


Sono state identificate nove coppie di linee, che si traducono in una dimensione del punto focale di 1,8 mm. Poiché le due coppie di linee più esterne erano in dissolvenza, è stata assegnata un’incertezza di +/- 0,2 mm. La dimensione della macchia focale può essere considerata circolare.
La penombra del fascio è stata misurata per tutte le dimensioni del collimatore di 4, 5, 7,5, 10,0, 12,5, 15, 20 e 25 mm a 5 cm e 10 cm di profondità a SSD = 45 cm. La penombra del fascio è stata definita come la distanza tra i punti di intensità dall’80% al 20%. La Figura 8 mostra i profili del fascio per il collimatore da 25 mm, che rappresenta la dimensione del campo di calibrazione.

La tabella 1 mostra il riepilogo dei valori di penombra per tutte le dimensioni del collimatore a 5,0 cm e 10 cm di profondità.
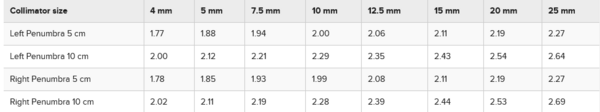
Tabella 1: Valori di penombra in mm per tutte le dimensioni del collimatore a 5,0 cm e 10,0 cm di profondità.
Vengono registrati i valori più alti della penombra del piano della ruota e dell’ortopiano. Il piano della ruota è definito come il piano che contiene la ruota del collimatore. L’ortopiano è perpendicolare ad esso.
Il profilo di esposizione alle radiazioni è stato misurato con la pellicola Gafchromic all’isocentro utilizzando il massimo materiale di accumulo (Figura 9). La pellicola esposta è stata sottoposta a scansione e la trasmissione della pellicola esposta è stata rappresentata nella Figura 10.

Radiazione di dispersione del collimatore Linac
Come descritto in precedenza, il collimatore del sistema Zap-X è stato progettato con valori di perdita estremamente bassi, superiori agli standard IEC 60601-2-1, v. 2014. La radiazione di dispersione è stata valutata attraverso la misurazione in diversi punti discreti. L’apparecchiatura di misurazione consisteva in una camera di dispersione calibrata di grande volume di Radcal, modello 10X6-180, S/N 08-0727 (RadCal Corp., Monrovia, CA) e in un misuratore di rilevamento Victoreen™ basato su una camera a ionizzazione, modello 451 BRYR, S/N 0000003284 (Fluke Biomedical, Cleveland, OH) in varie posizioni nel piano del paziente e accanto all’alloggiamento del collimatore Zap-X. Entrambe le camere sono state calibrate presso un laboratorio di calibrazione dosimetrica accreditato (ADCL). Tutte le misurazioni sono state eseguite con un collimatore vuoto selezionato (cioè la ruota del collimatore era posizionata in modo che il fascio intercettasse il materiale solido di tungsteno).
Nel piano paziente, è stata misurata una perdita massima alla stazione #8 con un valore di 10,4 mR. Poiché durante questa misurazione sono state erogate 1.000 unità monitor (MU), sull’asse centrale si è verificata un’esposizione di 1.000 Roentgen (R) e quindi 10,4 mR corrispondono allo 0,00104% dell’intensità del fascio primario. Un grafico che indica le posizioni è riportato nella Figura 11a. Lungo l’acceleratore lineare, è stata misurata una perdita massima alla stazione #3 con un valore di 6,8 mR. Poiché durante questa misurazione sono state erogate 1.000 MU, si è verificata un’esposizione di 1.000 R sull’asse centrale e quindi 6,8 mR corrispondono allo 0,00068% dell’intensità del fascio primario. Un grafico che indica le posizioni è riportato nella Figura 11b.

Poiché le norme IEC richiedono un massimo dello 0,1% di radiazioni di dispersione nel piano del paziente e lungo l’acceleratore lineare, lo Zap-X supera i requisiti di questa norma di due ordini di grandezza.
Indagine sulle radiazioni e sicurezza dalle radiazioni
Come mostrato in precedenza, lo Zap-X può essere considerato autoschermato, nel senso che in condizioni operative standard pesanti, a 1 m di distanza dal perimetro dello Zap-X, il livello massimo di dose equivalente di radiazioni previsto è inferiore a 1 mSv/anno, che equivale al limite di esposizione della popolazione.
Le condizioni operative standard di tipo pesante presuppongono il trattamento di un totale di 2.250 pazienti per un’operazione molto intensa, tutti con una singola frazione. Si ipotizza di trattare una testa sferica (20 cm di diametro) con il bersaglio al centro della sfera a 10 cm di profondità. Per il bersaglio, la prescrizione è di 2.500 centiGray (cGy) all’80% di isodose, dimensione del collimatore 25 mm (fattore di uscita (OF) 1,0) e profondità di 10 cm (rapporto tessuto-fantasma (TPR) ~0,5). Le MU risultanti per trattamento sono 6.250 MU. Con la distribuzione dei pazienti data, saranno erogate in totale 56.250 MU al giorno o 1,406 x 107 MU all’anno. Questo si traduce in 156,25 ore/anno di tempo di “Rad On”; pertanto, avremo un fattore di utilizzo di 156,25/2.000 = 0,0781. La schermatura deve essere progettata per 500 mrem/anno o 0,25 mrem/ora. Applicando il fattore di utilizzo, il tasso di esposizione istantanea consentito è di 3,2 mrem/ora a 1 m. Questo valore dovrebbe diminuire se l’utilizzo del sistema aumenta. Per stabilire un perimetro sicuro per gli addetti alle radiazioni, una volta definito il progetto definitivo, sarà necessario stabilire la distanza dal sistema ZAP in tutte le direzioni, alla quale vengono rilevati 3,2 mR/ora.
Solo nelle condizioni operative più estreme (con più di 50 pazienti trattati a settimana) le caratteristiche di autoschermatura non sarebbero valide. In tal caso, una riassegnazione dell’area nelle immediate vicinanze dello Zap-X all’esposizione professionale con 5,0 mSv/anno consentirebbe di quintuplicare il censimento dei pazienti e di mantenere l’autoschermatura per i lavoratori addetti alle radiazioni.
I risultati dell’indagine sulle radiazioni sono riportati nella Tabella 2 come elenco dei punti di misurazione e nella Figura 12 che mostra i punti di misurazione. Tutti i valori di dose annuale previsti sono risultati inferiori a 1,0 mSv, che equivale al limite di dose pubblica annuale.

Beam pos: posizione del fascio; mR/hr: milliroentgens per ora; U: fattore di utilizzo; D/C: ciclo di lavoro; Ann Dose (mSv): dose annuale in millisieverts; G: gantry
Il tasso di esposizione istantaneo massimo rilevato è stato rilevato nella stazione di misurazione 1 con 3,0 mR/ora. Poiché questo valore è inferiore al tasso di esposizione istantanea massimo consentito di 3,2 mR/ora, è considerato sicuro per la popolazione.
Camera di ionizzazione per il monitoraggio della dose
La camera di ionizzazione con monitoraggio della dose misura la quantità di radiazioni erogate per garantire che il rateo di dose e la dose assoluta vengano erogati come prescritto. A causa delle dimensioni molto ridotte del campo massimo, pari a 2,5 cm di diametro all’isocentro, non viene effettuato alcun monitoraggio della planarità o della simmetria. La camera di monitoraggio della dose consiste in un design a doppia camera di ionizzazione con due unità a funzionamento indipendente per garantire ridondanza e sicurezza.
La riproducibilità e la linearità della risposta del monitor di dose sono state analizzate con un sistema indipendente di misurazione della dosimetria assoluta PTW (Physikalisch-Technische Werkstaetten, Freiburg, Germania) e i risultati sono risultati conformi agli standard IEC 60601-2-1 [4]. La Figura 13 mostra i risultati della riproducibilità della risposta della camera (a) e della linearità della risposta (b).
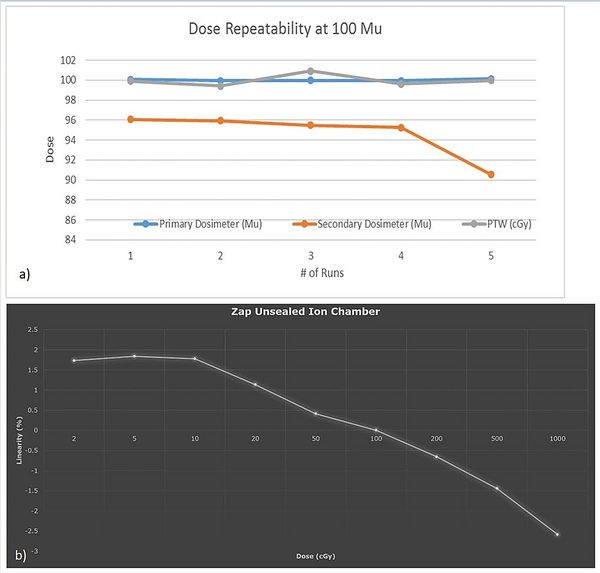
Si può concludere che la riproducibilità del monitor di dose rimane entro il +/-2%, mentre la linearità della risposta rimane entro il +/-3% nell’intervallo di MU clinicamente applicabili da 2 MU a 1.000 MU.
Normative – IEC – e come si rapporta ai requisiti di progettazione del sistema e dei test
Il sistema Zap-X è stato progettato in conformità a tutte le normative IEC applicabili in materia di sicurezza elettromagnetica (EM) e meccanica, sicurezza dalle radiazioni, funzionamento e prestazioni dell’acceleratore lineare e del sistema di imaging. Le norme IEC 60601-2-1, 61217 e 62083 sono state utilizzate per progettare gli aspetti applicabili del sistema [4, 7-8]. Le caratteristiche interessate sono la perdita di radiazioni, le prestazioni del fascio e le caratteristiche di sicurezza.
Specifiche di prestazione del fascio e test di accettazione del sistema
Le specifiche di prestazione del fascio Zap-X e i criteri di collaudo del sistema sono stati stabiliti in base ai requisiti clinici e alle capacità del sistema e sono stati definiti come segue:
(1) Energia del fascio di fotoni: Energia del fascio di fotoni singoli di 3,0 MV; PDD = 40% ± 2% per un campo circolare di 2,5 cm a 45 cm di SSD.
(2) Velocità di dose: 1.500 MU/min a 45 cm di distanza dall’asse della sorgente (SAD); 1 MU = 1 cGy a SAD = 45 cm, dimensione del campo di 2,5 cm, alla profondità della dose massima; la linearità non deve superare il ±3%; la riproducibilità di ± 2 MU o del 2%, a seconda di quale sia il valore maggiore; la stabilità della dose in orientamento di ± 2 MU o del 3%, a seconda di quale sia il valore maggiore.
(3) La simmetria del fascio non deve superare il ± 2%.
(4) La dispersione di radiazioni sul piano del paziente deve essere inferiore allo 0,1%.
(5) La radiazione al di fuori del piano paziente a 1 metro dalla linea centrale del fascio deve essere inferiore allo 0,1%.
(6) La trasmissione del collimatore deve essere inferiore all’1%.
(7) Interblocchi di sicurezza delle radiazioni.
Le prove di accettazione del sistema comprendono i seguenti aspetti
(1) Prove meccaniche: Isocentricità del portale assiale/obliquo: +/- 1,0 mm; posizione del laser sul centro fisico del collimatore: +/- 1,0 mm; Precisione delle posizioni principali: home/QA, RT/LT lat: +/- 0,5 gradi
(2) Dosimetria: Calibrazione assoluta (SAD: 45 cm, d = dmax): 1,0 cGy/MU +/- 2%; Riproducibilità (100 MU): +/- 1%; Stabilità della dose: 1.500 MU/min +/- 10%; Linearità con la dose (da 2 MU a 1.000 MU): +/- 3%
(3) Prestazioni del fascio: potenziale di accelerazione per rapporto di ionizzazione (I20/I10): 0,505 +/-0,05; determinazione dell’energia mediante PDD a SSD = 45 cm: 40,0% +/- 2%; simmetria del fascio (collimatore da 25 mm): +/- 2,0%; centratura del campo intorno a cax: +/- 0,5 mm; coincidenza del laser con il cax del fascio: +/- 0,5 mm; Dimensione del campo di radiazione pari alla dimensione dichiarata del collimatore: +/- 0,25 mm; penombra del fascio (distanza 80% – 20% a 10 cm di profondità): ≤ 4,0 mm
(4) Rivelatore MV: La riproducibilità e la linearità della risposta devono corrispondere alle prestazioni della camera di ionizzazione del monitor di dose.
(5) Imaging a kV: Risoluzione spaziale; risoluzione a basso contrasto; uniformità dell’immagine; indicazione del centro del dispositivo di imaging e coincidenza con il cax del fascio; verifica della precisione dimensionale (direzioni x e y).
(6) Sicurezza: Massima radiazione al paziente (rispetto a cax, a dmax, SAD = 45 cm): ≤ 0,1%; Perdita all’esterno dell’alloggiamento ZAP a 1,0 m di distanza: ≤ 3,0 mR/ora; Test di interblocco del guscio, della porta e dei pulsanti di interruzione.
Dati del fascio e qualificazione del sistema di pianificazione del trattamento
È stata acquisita una serie completa di dati sul fascio con il phantom acquatico PTW 3D. Il fascio di fotoni da 3 MV è stato caratterizzato acquisendo i valori di PDD per tutte le dimensioni del collimatore disponibili e fino a una profondità di 20 cm, i rapporti di decentramento (OCR) per tutte le dimensioni del collimatore a 0,7 cm (dmax), 2. 5 cm, 5,0 cm, 10 cm, 20 cm e 25 cm, nonché i fattori di uscita del collimatore a dmax e SAD = 45,0 cm per tutte le dimensioni del collimatore di 4,0, 5,0, 7,5, 10,0, 12,5, 15,0, 20,0 e 25,0 mm.
I set di dati campione per la PDD sono mostrati nella Figura 14, mentre i valori OCR sono mostrati nella Figura 15.

MV: megavoltaggio

MV: megavoltaggio
La Figura 16 mostra i fattori di uscita misurati con la camera di ionizzazione a punta di spillo PTW modello 31022 e il rivelatore a diamante PTW modello TN60019 (Physikalisch-Technische Werkstaetten, Freiburg, Germania).
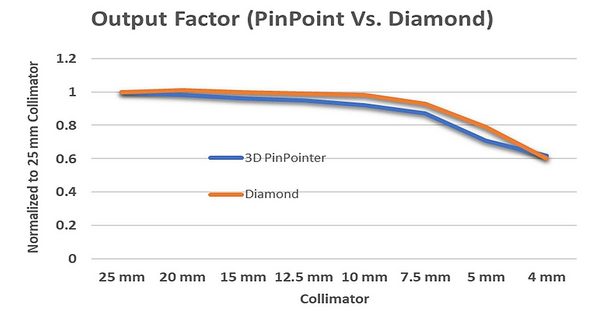
Poiché lo Zap-X ha una configurazione di sistema unica, abbiamo utilizzato esclusivamente un sistema water phantom PTW MP3XS 3D per le misurazioni dei dati del fascio. Per sostenere il phantom d’acqua è stato utilizzato un telaio di supporto dedicato, montato in modo sicuro all’estremità anteriore del letto del paziente con manopole regolabili a tre livelli. Il livello del fantasma d’acqua è stato regolato prima di spostarsi nell’area di scansione.
È stato configurato un collimatore a revolver con otto diversi fori di collimazione che producono con precisione dimensioni del fascio all’isocentro che vanno da 4 mm, 5 mm, 7,5 mm, 10 mm, 12,5 mm, 15 mm, 20 mm e 25 mm. Il collimatore da 25 mm è il collimatore di riferimento per la calibrazione della dose assoluta. Per livellare l’alloggiamento del collimatore da 25 mm, è stato utilizzato un kit di allineamento per individuare la posizione perpendicolare alla superficie dell’acqua regolando il gantry obliquo. È stato utilizzato un dispositivo isocentrico per fornire la distanza necessaria per un SAD di 45,0 cm e la posizione centrale per il phantom d’acqua. Allineando e regolando il dispositivo di puntamento PTW con il dispositivo di isocentro utilizzando il pendente di controllo PTW (Physikalisch-Technische Werkstaetten, Freiburg, Germania), è stata definita l’origine del sistema di scansione.
Quando il livello dell’acqua è stato raggiunto dalla punta del puntatore PTW, il puntatore è stato sostituito dal diodo dosimetrico PTW per l’acquisizione dei dati del fascio (Physikalisch-Technische Werkstaetten, Freiburg, Germania). Poiché si utilizzano spot del fascio di dimensioni ridotte, in particolare 4 e 5 mm, per ottenere una misura più accurata del fattore di uscita è necessaria la più piccola camera di ionizzazione PTW da 0,016 ccm. Per gli stessi motivi, viene utilizzata una camera di riferimento a trasmissione PTW radiotrasparente (Physikalisch-Technische Werkstaetten, Freiburg, Germania). Il phantom acquatico PTW 3D è mostrato nella Figura 17.

3D: tridimensionale
La funzionalità e l’accuratezza del sistema di pianificazione del trattamento sono state verificate calcolando in modo indipendente la dose attesa in vari scenari: configurazione SSD a fascio singolo (Figura 18A), configurazione SAD (Source Axes Distance) a fascio singolo (Figura 18B) e configurazione isocentrica a due fasci (Figura 19). La dose attesa calcolata è stata calcolata utilizzando la seguente formula:
D(x) = 1 (cGy/MU) x OCR (coll, deff, OAD) x TPR (coll, deff) x OF (coll) x (450/SAD)2,
dove:
x = posizione in cui viene calcolata la dose
coll = dimensione del collimatore;
deff = profondità effettiva lungo l’asse centrale per la posizione x;
OAD = distanza fuori asse da x all’asse;
SAD = distanza dalla sorgente al punto di proiezione di x sull’asse centrale.

PDD: dose percentuale di profondità; TMR: rapporto tessuto-massimo

Gli indici di conformità del singolo isocentro per la linea di isodose di prescrizione, le linee di isodose dell’80%, 70%, 60%, 50%, 40% e 30%, sono stati calcolati in relazione al volume target e sono riportati nella Tabella 3.

Normalizzati al volume dell’isodose dell’80%.
cm3: centimetro cubo
La dose attesa calcolata è stata confrontata con la dose prevista dal sistema di pianificazione del trattamento ed è risultata accettabile secondo le linee guida dell’American Association of Physicists in Medicine (AAPM).
Programma di garanzia della qualità
È stata sviluppata e implementata una serie completa di procedure di AQ principali, tra cui la verifica giornaliera dell’output, la verifica settimanale delle prestazioni del fascio, la calibrazione mensile dell’output e una calibrazione annuale per la verifica dei dati di base stabiliti durante la messa in funzione del sistema.
Quotidianamente
Interblocco della porta e interblocco dell’interruttore a chiave; test della luce “Rad-On”; test di selezione del collimatore; riscaldamento di 6.000 MU; verifica della calibrazione assoluta della dose dell’acceleratore lineare per la dimensione del collimatore più grande; test dell’allineamento del laser con il puntatore dell’isocentro; test della funzionalità completa del sistema, preprogrammato: tutte le rotazioni; segnalazione di tutti i parametri operativi rilevanti dal punto di vista funzionale: vuoto, rateo di dose, prestazioni del magnetron e altri parametri operativi dell’acceleratore lineare; test di posizionamento giornaliero di tipo Winston-Lutz
Settimanale
Simmetria di campo dell’acceleratore lineare; test end-to-end (E2E) per il collimatore più grande
Mensile
Verifica della calibrazione della dose assoluta con la camera di ionizzazione certificata ADCL; verifica del rapporto di ionizzazione con un phantom di acqua solida dedicato
Trimestrale
Test di allineamento del sistema di imaging; test di qualità del sistema di immagine; test di posizionamento del lettino del paziente secondo il Task Group (TG) 101 dell’AAPM.
Annualmente
Calibrazione completa della dose assoluta secondo AAPM TG 51; misurazioni della PDD, del fattore di uscita del collimatore e del rapporto di decentramento; verifica dei dati utilizzati nel sistema di pianificazione del trattamento (TPS); verifica della funzionalità del TPS e dell’accuratezza dei calcoli; test E2E completi, compreso il fantasma umanoide RANDO® (Imaging Solutions, Pty Ltd.), Shailer Park, Australia): imaging con tomografia computerizzata (TC), trasferimento al TPS, pianificazione del trattamento, AQ specifico per il paziente, consegna del piano, valutazione dell’accuratezza della distribuzione della dose erogata e misurazione della dose assoluta con la camera di ionizzazione incorporata nel phantom. Valutazione completa dei sistemi di sicurezza, posizionamento della ruota girevole del collimatore, prevenzione delle collisioni paziente-collimatore e restrizioni sul posizionamento del lettino.
La Figura 20 mostra gli strumenti di AQ specifici per Zap-X.

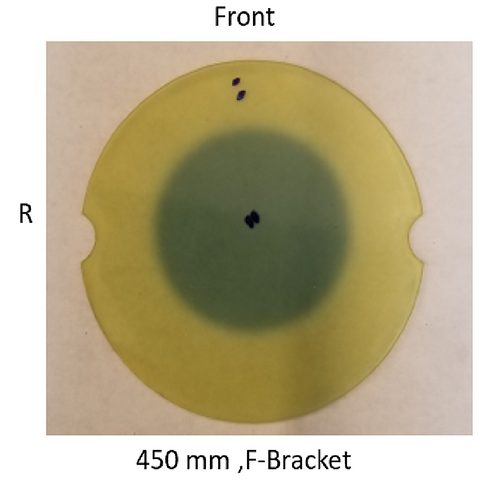
Per verificare l’accuratezza complessiva del sistema, verrà eseguito un test settimanale end-to-end che comprende l’imaging TC, il contouring, la pianificazione del trattamento, l’erogazione del trattamento e la valutazione del trattamento. La pellicola gafchromica viene inserita nel cubo a sfera incorporato nel fantasma del cranio antropomorfo (Figura 21). Dopo l’esposizione della dose di trattamento, la pellicola viene valutata per determinare il centro della sfera di esposizione rispetto al centro del cubo a sfera. I risultati sono mostrati nella Figura 22.


Discussione
Poiché non esistono standard per i sistemi SRS intracranici dedicati a fascio esterno a questa energia di trattamento, i risultati sopra presentati serviranno come serie di parametri di base per la nuova classe di dispositivi specializzati per il trattamento delle radiazioni. Ulteriori parametri, come la riproducibilità dei parametri per i sistemi di produzione successivi e la stabilità individuale a lungo termine, restano da esplorare e determinare.
Conclusioni
Il sistema Zap-X è risultato conforme ai requisiti di sicurezza, precisione e prestazioni ampiamente accettati nel settore della radioterapia e della radiochirurgia. Inoltre, il sistema ha dimostrato di soddisfare le esigenze cliniche pratiche della comunità dei radiochirurghi.
Fonte: cureus.com

SOSTIENICI TRAMITE BONIFICO:
IBAN: IT19B0306967684510332613282
INTESTATO A: Marco Stella (Toba60)
SWIFT: BCITITMM
CAUSALE: DONAZIONE









